Vantaggi
Vantaggi clinici ed industriali.
Partendo dalla considerazione che attualmente la paralisi da lesione del midollo spinale è orfana di trattamento il primo potenziale e grande vantaggio sarà la rigenerazione del midollo spinale e il recupero locomotorio.
Si tratta di un secondo uso farmaceutico, quindi è nota la tossicità, i dosaggi, gli effetti terapeutici e collaterali. L’uso nell’uomo (FDA ed AIFA) è approvato per numerose patologie neurologiche, muscolari e dermatologiche oltrechè utilizzata off label per numerosi impieghi clinici che utilizzano le diverse formulazioni commerciali (BOTOX® Dysport®, Vistabex®, Xeomin®).
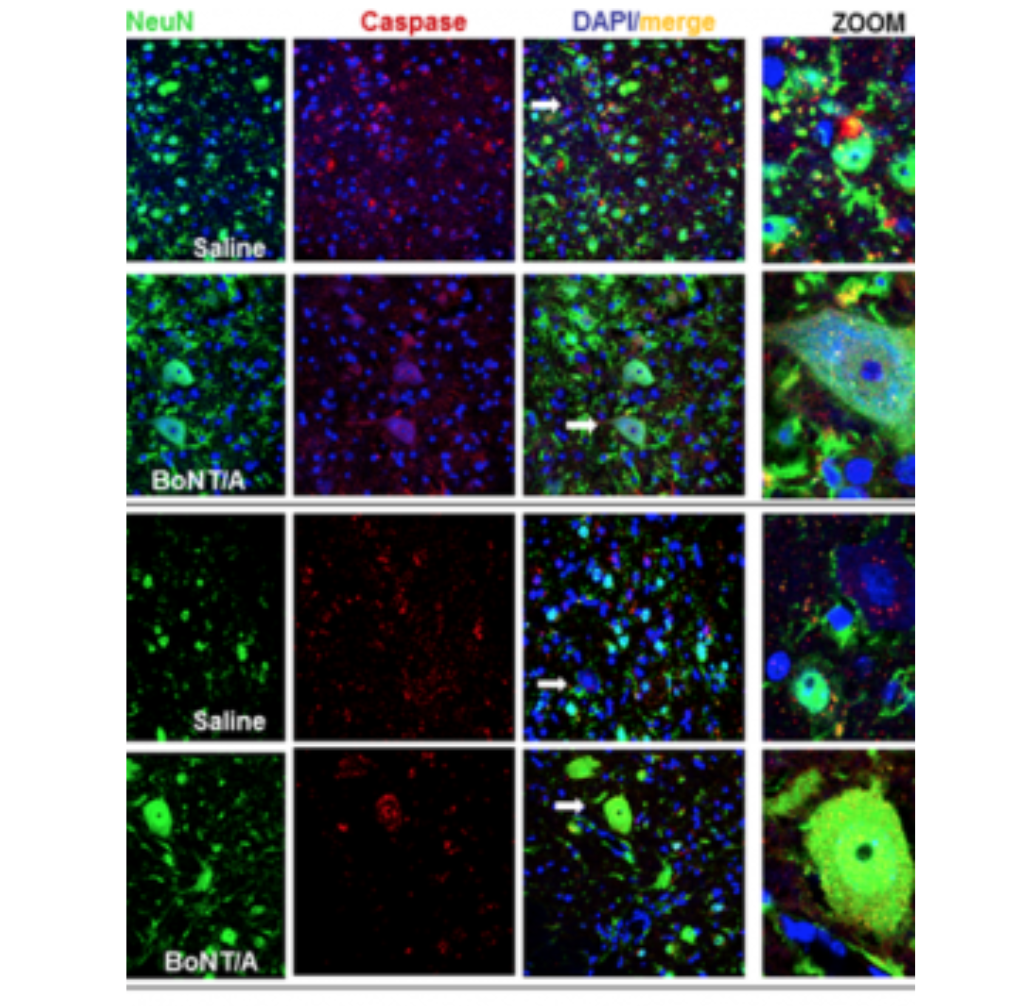
La sperimentazione animale (preclinica) per il nuovo uso terapeutico è già stata effettuata e la dimostrazione di efficacia, in topi con contusione spinale e paralisi completa, pubblicata (Vacca et al. Toxins, 2020). Le dosi utilizzate (15 picogrammi/topo), con effetto terapeutico, non presentano tossicità, sono sicure ed inferiori a quelle usate in clinica (100U Botox ῀ 4,8 nanogrammi/uomo).
Grazie alla sua azione biologia un singolo trattamento (somministrazione di un’unica dose) è in grado di svolgere un’attività terapeutica dai 2 ai 6 mesi, in modo costante, evitando continue e ripetute somministrazioni.