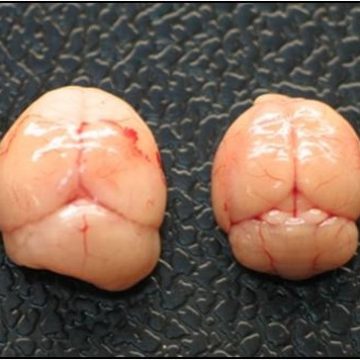
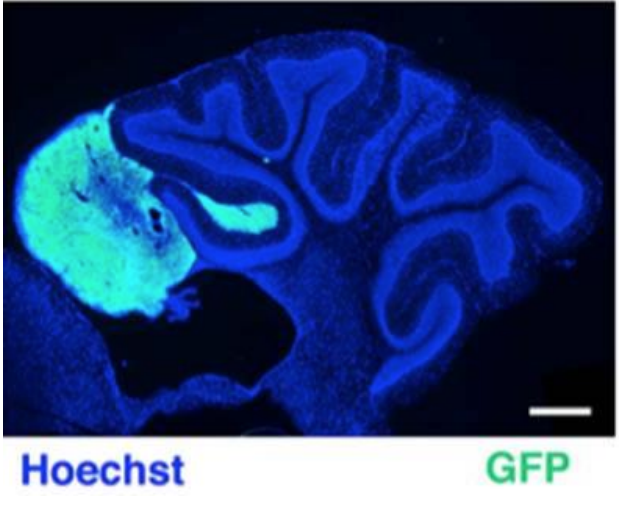
Il medulloblastoma (MB), il tumore del cervelletto, è una delle principali cause di mortalità infantile per cancro. In un modello murino di MB spontaneo, è stata dimostrata la correlazione tra MB e un difetto della migrazione delle cellule precursori cerebellari (GCPs). La chemiochina Cxcl3, responsabile della migrazione dei GCPs, può pertanto sopprimere lo sviluppo delle lesioni preneoplastiche.