Sinergia tra due farmaci: LA SCOPERTA del Prof. Piva – (Blood 2018): approccio sinergico di due farmaci somministrati in dosi sub-letali e sub-tossiche, solo insieme portano a morte cellulare marcata e preferenziale sulle cellule tumorali.
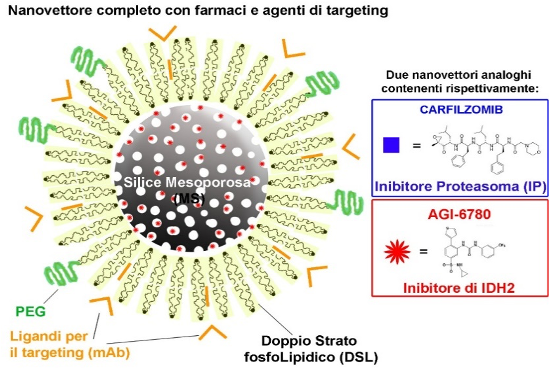
Farmaco 1. inibitore del proteasoma (già somministrato tradizionalmente per via sistemica – svantaggi: tossicità e ricadute frequenti)+ Farmaco 2. inibitore di IDH2 (Non utilizzato tradizionalmente per tossicità elevata e bassa biodistribuzione è escluso dalla traslazione clinica).
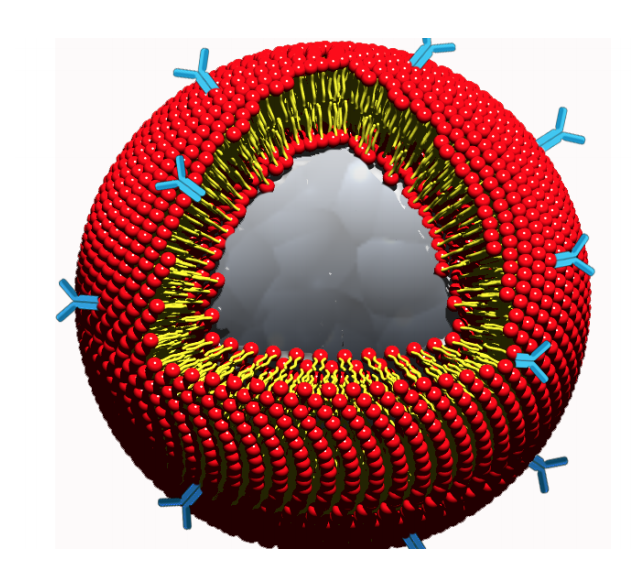
il DRUG DELIVERY SYSTEM della Prof. Cauda – (Nanoletters 2010, Nanomedicine 2020): Nanoparticelle che presentano biomimetismo, non-immunogenicità, contenimento di uno o più farmaci, dispersione colloidale, trasporto nel flusso sanguigno, targeting mirato delle cellule cancerogene, accesso e rilascio intracellulare per ottenere l’azione citotossica nelle cellule tumorali.
OGGI la tecnologia si trova a TRL 4:
Validazione in-vitro: provata la nanoveicolazione e migliorata efficacia e efficienza de farmaci nanoveicolati. Diamo nuovo valore a farmaci approvati, ma che avevano fallito la traslazione clinicaè NUOVO SISTEMA NANOVEICOLATO MIRATO a cellule tumoali e BIOCOMPATIBILE
Prospettiva a 1 anno: TRL 5
Trial preclinici in vivo, Validazione verso ALTRE FORME TUMORALI (altri tumori ematologici e tumori solidi), Fondazione Start-up per raccolta ulteriori fondi, Road di validazione dispositivo medico classe III