
Maristella Maggi
11 novembre 2020
16:00 - 18:00
Orphan and rare diseases from different perspectives.
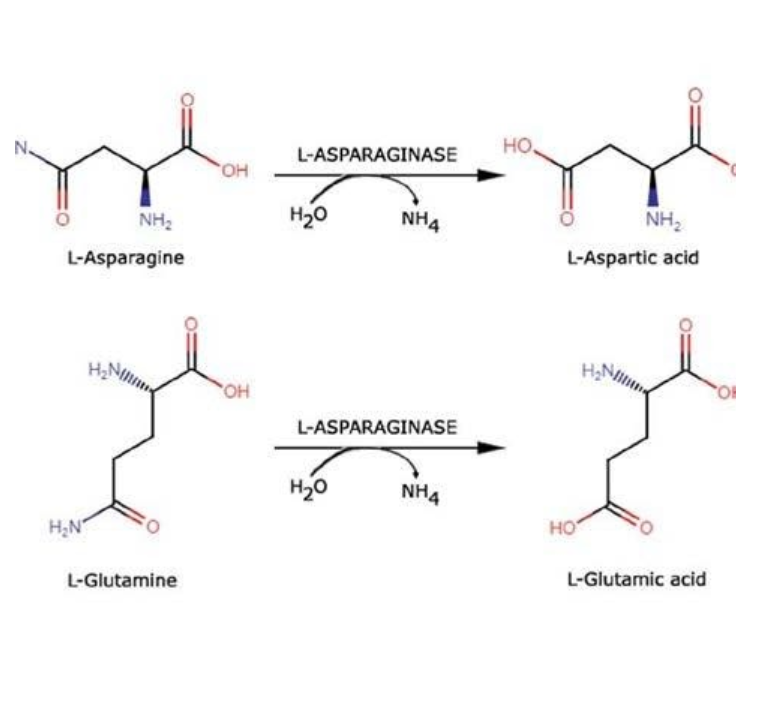
L’invenzione consiste in una variante di un farmaco di natura proteica, la L-Asparaginasi (ASNasi), utilizzato
per il trattamento dei tumori e, più specificamente, per il trattamento della leucemia linfoblastica acuta (LLA).

Stato del brevetto
CONCESSO

Numero di priorità
PCT/IB2018/057259 US 2019/0270978 CN110462035 JP2019/535308 IN201917020880

Data di priorità
08/11/2016

Licenza
INTERNAZIONALE

Mercato
Il farmaco dal quale la molecola brevettata deriva è utilizzato da più di 40 anni nella clinica come farmaco di prima linea per il trattamento della leucemia linfoblastica acuta infantile. Sono pertanto disponibili analisi di mercato recenti e attendibili che mostrano una copertura mondiale per la commercializzazione del farmaco. I principali stakeholder sono rappresentati da grandi aziende farmaceutiche, in particolare quelle già presenti nel settore specifico delle asparaginasi quali: Jazz Pharmaceuticals France Sas (Erwinase® e Kidrolase®) Medac Gesellschaft Fuer Klinische Spezialpraeparate MbH (Spectrila®) Shire S.p.a. e Baxalta (Oncaspar®)
Problema
Le L-asparaginasi (ASNasi) sono state utilizzate come farmaci di prima linea per il trattamento della leucemia linfoblastica acuta (LLA) pediatrica da oltre 40 anni. Sia l'Escherichia coli (EcAII) che l'Erwinia chrysanthemi (ErAII) tipo II ASNasi attualmente utilizzate nelle cliniche sono caratterizzate da elevata instabilità in vivo, breve emivita e la necessità di diverse somministrazioni per ottenere una concentrazione farmacologicamente attiva. Inoltre, sono sensibili alle proteasi (catepsina B e asparagina endopeptidasi) che sono sovraespresse dai linfoblasti leucemici resistenti, compromettendo così l'attività del farmaco e la farmacocinetica. Portare un nuovo farmaco al mercato richiede tipicamente dieci anni e milioni di euro, un costo che può essere sostenuto solo da grandi industrie farmaceutiche. In questo caso, un grande vantaggio che riduce drasticamente sia i tempi, sia i costi dell’introduzione in clinica del farmaco deriva dal fatto che la molecola porta una sola mutazione puntiforme rispetto a quella naturale, mantenendo inalterata l’attività enzimatica e, anzi, presentando ulteriori aspetti utili.
Limiti attuali tecnologie / Soluzioni
La terapia a base di ASNasi ha una buona efficacia nel trattamento della LLA pediatrica, ma circa il 10% dei pazienti trattati non risponde alla terapia di combinazione standard e il 10-20% dei bambini in remissione presenta una ricaduta entro 5 anni. Lo stress metabolico indotto dalla deplezione di L-Asn e L-Gln, la risposta immunitaria dell'ospite e la stabilità limitata dell'ASNasi in vivo sono tra le cause più importanti del fallimento della terapia. Pertanto le attuali terapie sono caratterizzate da un'elevata instabilità in vivo, una breve emivita e l'esigenza di diverse somministrazioni. La nuova variante brevettata N24S la rendono un potenziale trattamento alternativo per ridurre il numero di somministrazioni di farmaci in vivo e per affrontare con successo una delle principali sfide attuali del trattamento LLA: inattivazione spontanea, proteasi-dipendente e immunologica di ASNasi. Infatti N24S presenta: aumentata stabilità nel tempo e ad elevate temperature e resistenza alla degradazione proteolitica da parte di proteasi tumorali.
Tecnologia e nostra soluzione
La variante di ASNasi brevettata ha caratteristiche migliori rispetto a quelle pre-esistenti, in termini di un’accresciuta stabilità in vivo, una più lunga emi-vita, una ridotta sensibilità a specifici enzimi (proteasi) che sono sovra-espressi dalle cellule tumorali e che contribuiscono ad eliminare il farmaco rapidamente.
Ciò la rende un’interessante alternativa per ridurre il numero di somministrazioni e far fronte alle altre problematiche correlate al trattamento della LLA.
Il fatto che la molecola porti una sola mutazione puntiforme rispetto a quella naturale, mantenendo inalterata l’attività enzimatica e, anzi, presentando ulteriori aspetti utili, rappresenta un grande vantaggio che riduce drasticamente sia i tempi che i costi dell'introduzione in clinica del farmaco.
Test preclinici sono in corso.
Vantaggi
Attività asparaginasica e glutaminasica preservate
Stabilità a lungo termine, permettendo teoricamente una riduzione della dose somministrata;
Parametri termici migliorati
Eccellente resistenza alle proteasi derivate dalle cellule leucemiche, permettendo teoricamente il trattamento di pazienti con forme di leucemia resistenti alla molecola attuale.
La modifica apportata alla molecola la rende meno immunogena per il paziente, permettendo potenzialmente una somministrazione con ridotti effetti collaterali.
Roadmap
Per raggiungere la fase di sviluppo clinico della molecola sono necessari almeno 5 anni e un budget stimato di 2.000.000 €.
Il punto più critico per lo sviluppo del farmaco sono gli studi in vivo prima su modelli animali della malattia e poi su pazienti (trialclinici).
Abbiamo avuto interazioni dirette con l’ITF di EMA, che suggerisce la richiesta di status di orphan drug.
TRL
Il team

